| Piero Stroppa - Didattica e divulgazione scientifica | Home |
Didattica |
| Ripasso di Fisica per il Biennio delle Superiori |
| Unità 15. La termodinamica e il problema energetico |
| DEFINIZIONI E TABELLE | Esercizi svolti, esperienze e attività | Questionario |
| Attenzione:
se sei interessato a un argomento particolare, cercalo con il comando Trova (Ctrl+F) altrimenti, stampa questo documento e leggilo off-line |
![]() D1. In
alcune delle precedenti Unità sono stati descritti fenomeni
in cui una forma di energia si trasforma in parte o
totalmente in calore, a causa di attriti e resistenze
(l'energia meccanica nell’Unità 10, l'energia elettrica nell’Unità
13, l'energia delle onde
nell’Unità 14). Queste trasformazioni e le trasformazioni
del calore in altre forme di energia sono oggetto di studio
della termodinamica.
D1. In
alcune delle precedenti Unità sono stati descritti fenomeni
in cui una forma di energia si trasforma in parte o
totalmente in calore, a causa di attriti e resistenze
(l'energia meccanica nell’Unità 10, l'energia elettrica nell’Unità
13, l'energia delle onde
nell’Unità 14). Queste trasformazioni e le trasformazioni
del calore in altre forme di energia sono oggetto di studio
della termodinamica.
![]() D2.
L'equivalenza tra calore e lavoro è stata sancita dalle
misure effettuate da J.P. Joule, dimostrando che il calore è
una forma di energia (energia termica).
Joule ha determinato l'equivalente meccanico della Caloria,
il cui valore è 4186 J/Cal. Questo significa che
dalla completa trasformazione in calore di un'energia
di 4186 J si ottiene una Caloria.
D2.
L'equivalenza tra calore e lavoro è stata sancita dalle
misure effettuate da J.P. Joule, dimostrando che il calore è
una forma di energia (energia termica).
Joule ha determinato l'equivalente meccanico della Caloria,
il cui valore è 4186 J/Cal. Questo significa che
dalla completa trasformazione in calore di un'energia
di 4186 J si ottiene una Caloria.
![]() D3. L'energia
interna U di un sistema fisico è la somma
dell'energia cinetica e di quella potenziale di tutte le
molecole che lo costituiscono (vedi la definizione D23 dell’Unità
10).
D3. L'energia
interna U di un sistema fisico è la somma
dell'energia cinetica e di quella potenziale di tutte le
molecole che lo costituiscono (vedi la definizione D23 dell’Unità
10).
![]() D4. Quando
una parte dell'energia E fornita a un sistema si
trasforma in calore, si ottiene un aumento DU
dell'energia interna del sistema, che sommata al lavoro L
prodotto dalla trasformazione dà proprio l'energia fornita:
D4. Quando
una parte dell'energia E fornita a un sistema si
trasforma in calore, si ottiene un aumento DU
dell'energia interna del sistema, che sommata al lavoro L
prodotto dalla trasformazione dà proprio l'energia fornita:
E = L + DU
Questo è il primo principio della termodinamica, che costituisce una formulazione più generale del principio di conservazione dell'energia (vedi la definizione D22 dell’Unità 10).
L = -DU |
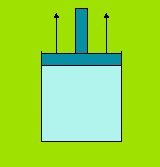 |
Una trasformazione realizzata in queste condizioni è detta adiabatica. Per esempio, un gas che si espande in un recipiente isolato termicamente si raffredda (e se viene compresso si riscalda).
![]() D7. Per
ottenere con continuità lavoro dal calore è però
necessaria una macchina termica che compia una
trasformazione ciclica, cioè una trasformazione in
cui il sistema ritorni periodicamente alla posizione
iniziale.
D7. Per
ottenere con continuità lavoro dal calore è però
necessaria una macchina termica che compia una
trasformazione ciclica, cioè una trasformazione in
cui il sistema ritorni periodicamente alla posizione
iniziale.
![]() D8. Dallo studio dei cicli
termodinamici (come il ciclo di Carnot), risulta che
non tutto il calore si riesce a trasformare in lavoro, ma
solo una parte di esso. In ogni ciclo viene prelevato il
calore Q1 da una sorgente ad alta
temperatura T1, e viene ceduto il calore Q2
a un termostato alla temperatura T2 (minore
di T1). Il lavoro prodotto nel ciclo è
quindi dato da:
D8. Dallo studio dei cicli
termodinamici (come il ciclo di Carnot), risulta che
non tutto il calore si riesce a trasformare in lavoro, ma
solo una parte di esso. In ogni ciclo viene prelevato il
calore Q1 da una sorgente ad alta
temperatura T1, e viene ceduto il calore Q2
a un termostato alla temperatura T2 (minore
di T1). Il lavoro prodotto nel ciclo è
quindi dato da:
L = Q1 - Q2
![]() D9. Queste
osservazioni costituiscono una delle possibili formulazioni
del secondo principio della termodinamica: è
impossibile che un ciclo di una macchina termica abbia come unico
effetto quello di estrarre calore da una sorgente e di
trasformarlo completamente in lavoro.
D9. Queste
osservazioni costituiscono una delle possibili formulazioni
del secondo principio della termodinamica: è
impossibile che un ciclo di una macchina termica abbia come unico
effetto quello di estrarre calore da una sorgente e di
trasformarlo completamente in lavoro.
![]() D10. Il rendimento r di una
trasformazione di energia è il rapporto tra l'energia
utile Eu prodotta e l'energia
assorbita Ea:
D10. Il rendimento r di una
trasformazione di energia è il rapporto tra l'energia
utile Eu prodotta e l'energia
assorbita Ea:
r = Eu / Ea
Per esempio, in un motore
elettrico l'energia assorbita è quella elettrica e l'energia
utile è quella meccanica dovuta al movimento del motore.
Spesso il rendimento viene espresso in forma percentuale:
r% = r • 100
![]() D11. La
differenza tra l'energia assorbita e quella utile (Ea
- Eu) rappresenta l'energia dispersa,
cioè che non si è trasformata o che è diventata calore.
D11. La
differenza tra l'energia assorbita e quella utile (Ea
- Eu) rappresenta l'energia dispersa,
cioè che non si è trasformata o che è diventata calore.
![]() D12. Se
l'energia assorbita non è il calore, il rendimento teorico
di una trasformazione è pari a 1, valore che potrebbe essere
raggiunto eliminando attriti e perdite varie, ma che non può
essere superato per il principio di conservazione
dell'energia.
D12. Se
l'energia assorbita non è il calore, il rendimento teorico
di una trasformazione è pari a 1, valore che potrebbe essere
raggiunto eliminando attriti e perdite varie, ma che non può
essere superato per il principio di conservazione
dell'energia.
![]() D13. In una macchina termica, dove
l'energia assorbita è il calore, nemmeno il rendimento
teorico può essere pari a 1, infatti si ha (vedi la
definizione D8):
D13. In una macchina termica, dove
l'energia assorbita è il calore, nemmeno il rendimento
teorico può essere pari a 1, infatti si ha (vedi la
definizione D8):
r = L / Q1 = (Q1 - Q2 ) / Q1 = 1 - Q2 / Q1 < 1
![]() D14.
Analizzando il ciclo termodinamico, si dimostra che il
rendimento teorico può essere calcolato anche tramite le
temperature (assolute, vedi la definizione D28
dell’Unità 6)
della sorgente e del refrigerante:
D14.
Analizzando il ciclo termodinamico, si dimostra che il
rendimento teorico può essere calcolato anche tramite le
temperature (assolute, vedi la definizione D28
dell’Unità 6)
della sorgente e del refrigerante:
r = 1 - T2 / T1
![]() D15. In
conseguenza dell’estrema facilità con cui tutte le
forme di energia si trasformano in calore, e della riluttanza
che ha invece il calore a trasformarsi in lavoro, l'energia
di ogni sistema, e quindi anche l'energia totale
dell'universo, sono destinate a un lento degrado,
diventando progressivamente energia termica a temperatura
sempre più bassa.
D15. In
conseguenza dell’estrema facilità con cui tutte le
forme di energia si trasformano in calore, e della riluttanza
che ha invece il calore a trasformarsi in lavoro, l'energia
di ogni sistema, e quindi anche l'energia totale
dell'universo, sono destinate a un lento degrado,
diventando progressivamente energia termica a temperatura
sempre più bassa.
![]() D16. Del
secondo principio della termodinamica si può dare una
spiegazione di tipo statistico. A livello molecolare
il calore è una forma disordinata di energia (ci sono
innumerevoli configurazioni delle molecole che corrispondono
a un determinato stato termico di un sistema), mentre le
altre energie sono forme ordinate (per esempio, esiste
una sola configurazione delle molecole di un corpo che si
muove in una data direzione con una determinata energia
cinetica), ed è noto che è più facile trasformare l'ordine
in disordine che compiere la trasformazione inversa.
D16. Del
secondo principio della termodinamica si può dare una
spiegazione di tipo statistico. A livello molecolare
il calore è una forma disordinata di energia (ci sono
innumerevoli configurazioni delle molecole che corrispondono
a un determinato stato termico di un sistema), mentre le
altre energie sono forme ordinate (per esempio, esiste
una sola configurazione delle molecole di un corpo che si
muove in una data direzione con una determinata energia
cinetica), ed è noto che è più facile trasformare l'ordine
in disordine che compiere la trasformazione inversa.
![]() D17. Si
chiama moto perpetuo (di seconda specie) quello
di una macchina che sfrutta l'energia termica utilizzando una
sola sorgente di calore. Una macchina siffatta è
irrealizzabile, in quanto violerebbe il secondo principio
della termodinamica.
D17. Si
chiama moto perpetuo (di seconda specie) quello
di una macchina che sfrutta l'energia termica utilizzando una
sola sorgente di calore. Una macchina siffatta è
irrealizzabile, in quanto violerebbe il secondo principio
della termodinamica.
![]() D18.
L'energia disponibile sulla Terra deriva per il 99% dalla
radiazione emessa dal Sole, il quale ricava l'energia dalle
reazioni di fusione nucleare dell'idrogeno, che
liberano l'energia nucleare nascosta nei
nuclei atomici. La fusione nucleare è dovuta alle altissime
temperature e pressioni che si realizzano nell'interno
solare: i nuclei di deuterio (D, un isotopo dell'idrogeno il
cui nucleo è composto di un protone e di un neutrone)
vincono la forza di repulsione elettrostatica e si fondono a
due a due per intervento dell'interazione nucleare forte,
formando nuclei di elio (He, vedi l’Unità
4).
D18.
L'energia disponibile sulla Terra deriva per il 99% dalla
radiazione emessa dal Sole, il quale ricava l'energia dalle
reazioni di fusione nucleare dell'idrogeno, che
liberano l'energia nucleare nascosta nei
nuclei atomici. La fusione nucleare è dovuta alle altissime
temperature e pressioni che si realizzano nell'interno
solare: i nuclei di deuterio (D, un isotopo dell'idrogeno il
cui nucleo è composto di un protone e di un neutrone)
vincono la forza di repulsione elettrostatica e si fondono a
due a due per intervento dell'interazione nucleare forte,
formando nuclei di elio (He, vedi l’Unità
4).
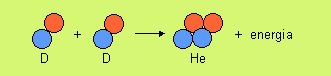
![]() D19. La
fusione nucleare libera una grande quantità di energia sotto
varie forme. Questa reazione viene realizzata anche sulla
Terra: si tratta della fonte di energia che si libera in modo
esplosivo nelle bombe termonucleari e in modo pacifico
nelle centrali a fusione. Queste ultime sono ancora a
livello sperimentale, a causa dei problemi di innesco e
di contenimento del gas sottoposto a reazione (sono
necessarie temperature di 107 K).
D19. La
fusione nucleare libera una grande quantità di energia sotto
varie forme. Questa reazione viene realizzata anche sulla
Terra: si tratta della fonte di energia che si libera in modo
esplosivo nelle bombe termonucleari e in modo pacifico
nelle centrali a fusione. Queste ultime sono ancora a
livello sperimentale, a causa dei problemi di innesco e
di contenimento del gas sottoposto a reazione (sono
necessarie temperature di 107 K).
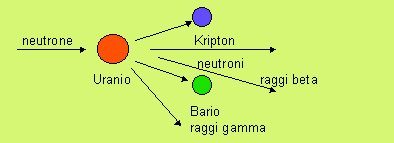
![]() D20. La fissione
nucleare è una reazione che avviene solo nei nuclei ad
elevato numero atomico (per esempio, l'uranio, o il
plutonio). Un nucleo di tali sostanze colpito da un neutrone
può spezzarsi in due nuclei più piccoli, emettendo energia
e altri neutroni, che in particolari condizioni possono
realizzare altre fissioni (reazione a catena).
D20. La fissione
nucleare è una reazione che avviene solo nei nuclei ad
elevato numero atomico (per esempio, l'uranio, o il
plutonio). Un nucleo di tali sostanze colpito da un neutrone
può spezzarsi in due nuclei più piccoli, emettendo energia
e altri neutroni, che in particolari condizioni possono
realizzare altre fissioni (reazione a catena).
![]() D21. Al
contrario della fusione, è relativamente più semplice
realizzare in modo controllato la fissione nucleare, che
viene quindi sfruttata per scopi pacifici. Nelle centrali
elettronucleari si sfrutta il calore emesso dalle
reazioni di fissione per alimentare le macchine termiche, che
a loro volta producono l'energia necessaria agli alternatori
per generare l'elettricità (vedi l’Unità 13). Il problema principale di questa fonte di
energia è rappresentato dalle sue scorie, che pur non
essendo più in grado di fornire energia, rimangono
radioattive, e quindi nocive per l’ambiente e per
l’uomo, per moltissimi anni.
D21. Al
contrario della fusione, è relativamente più semplice
realizzare in modo controllato la fissione nucleare, che
viene quindi sfruttata per scopi pacifici. Nelle centrali
elettronucleari si sfrutta il calore emesso dalle
reazioni di fissione per alimentare le macchine termiche, che
a loro volta producono l'energia necessaria agli alternatori
per generare l'elettricità (vedi l’Unità 13). Il problema principale di questa fonte di
energia è rappresentato dalle sue scorie, che pur non
essendo più in grado di fornire energia, rimangono
radioattive, e quindi nocive per l’ambiente e per
l’uomo, per moltissimi anni.
![]() D22. Nelle centrali
termoelettriche, le macchine termiche sono alimentate con
il calore fornito dalla combustione, una reazione
chimica che costituisce una delle più antiche fonti di
energia sfruttate dall'uomo.
D22. Nelle centrali
termoelettriche, le macchine termiche sono alimentate con
il calore fornito dalla combustione, una reazione
chimica che costituisce una delle più antiche fonti di
energia sfruttate dall'uomo.
![]() D23. Le reazioni
chimiche sono fenomeni che comportano delle modifiche nei
legami esistenti tra gli atomi della materia (ma senza alcun
intervento sui nuclei atomici, a differenza delle reazioni di
fissione e fusione).
D23. Le reazioni
chimiche sono fenomeni che comportano delle modifiche nei
legami esistenti tra gli atomi della materia (ma senza alcun
intervento sui nuclei atomici, a differenza delle reazioni di
fissione e fusione).
![]() D24. In
molte reazioni chimiche, le forze elettriche atomiche e
molecolari coinvolte producono un'energia (detta energia
chimica) che può manifestarsi con effetti termici
(nelle combustioni), meccanici (nelle esplosioni), elettrici
(nelle pile, vedi la definizione D31 dell’Unità
12), e elettromagnetici (emissione di luce).
D24. In
molte reazioni chimiche, le forze elettriche atomiche e
molecolari coinvolte producono un'energia (detta energia
chimica) che può manifestarsi con effetti termici
(nelle combustioni), meccanici (nelle esplosioni), elettrici
(nelle pile, vedi la definizione D31 dell’Unità
12), e elettromagnetici (emissione di luce).
![]() D25. Sono dette combustibili
quelle sostanze che bruciando trasformano la loro energia
chimica in energia termica, e si definisce potere
calorifico Pcal di queste sostanze la
quantità di calore che si ottiene dalla combustione completa
di 1 kilogrammo:
D25. Sono dette combustibili
quelle sostanze che bruciando trasformano la loro energia
chimica in energia termica, e si definisce potere
calorifico Pcal di queste sostanze la
quantità di calore che si ottiene dalla combustione completa
di 1 kilogrammo:
Pcal = Q / m
![]() dove Q
= calore prodotto dalla combustione; m = massa del
combustibile. Nel SI il potere calorifico si misura in joule/kg,
ma spesso si misura anche in Calorie/kg (1 Cal/kg =
4186 J/kg).
dove Q
= calore prodotto dalla combustione; m = massa del
combustibile. Nel SI il potere calorifico si misura in joule/kg,
ma spesso si misura anche in Calorie/kg (1 Cal/kg =
4186 J/kg).
![]() D26. Nella Tabella 13 sono riportati i poteri calorifici di
alcune sostanze. L'assimilazione organica degli alimenti è
un fenomeno molto più complesso della combustione chimica
(vedi l’esperienza A3), e la "combustione" nucleare non
coinvolge le reazioni chimiche, bensì quelle nucleari.
Tuttavia, si può mantenere la stessa terminologia trattando
solo l'effetto energetico di questi fenomeni.
D26. Nella Tabella 13 sono riportati i poteri calorifici di
alcune sostanze. L'assimilazione organica degli alimenti è
un fenomeno molto più complesso della combustione chimica
(vedi l’esperienza A3), e la "combustione" nucleare non
coinvolge le reazioni chimiche, bensì quelle nucleari.
Tuttavia, si può mantenere la stessa terminologia trattando
solo l'effetto energetico di questi fenomeni.
![]() D27. Le centrali
idroelettriche non utilizzano macchine termiche, in
quanto gli alternatori sono riforniti di energia meccanica da
parte delle turbine mosse dalla caduta dell'acqua (vedi
l’esercizio E7 dell’Unità 10), e per questo hanno un
rendimento elevato (circa del 90%).
D27. Le centrali
idroelettriche non utilizzano macchine termiche, in
quanto gli alternatori sono riforniti di energia meccanica da
parte delle turbine mosse dalla caduta dell'acqua (vedi
l’esercizio E7 dell’Unità 10), e per questo hanno un
rendimento elevato (circa del 90%).
![]() D28. La
"produzione" dell'energia, ovvero la
trasformazione in lavoro delle energie diffuse in natura,
può avvenire in modo diretto (per esempio, nei mulini a
vento), o tramite la trasformazione in energia elettrica per
comodità di trasporto e consumo (vedi l’Unità 13).
D28. La
"produzione" dell'energia, ovvero la
trasformazione in lavoro delle energie diffuse in natura,
può avvenire in modo diretto (per esempio, nei mulini a
vento), o tramite la trasformazione in energia elettrica per
comodità di trasporto e consumo (vedi l’Unità 13).
![]() D29. La
produzione e il consumo dell'energia comportano numerosi
problemi. Un problema riguarda le fonti (i giacimenti
di petrolio e di carbone sono in via di esaurimento), mentre
altri problemi sono quelli di ordine ecologico:
impatto sull'ambiente naturale (soprattutto per le centrali
idroelettriche), emissione di fumi e gas dannosi (da parte
delle centrali termoelettriche e dei motori a benzina e
gasolio), emissione di radiazioni nucleari e smaltimento
delle scorie radioattive (da parte delle centrali nucleari,
vedi la definizione D21).
D29. La
produzione e il consumo dell'energia comportano numerosi
problemi. Un problema riguarda le fonti (i giacimenti
di petrolio e di carbone sono in via di esaurimento), mentre
altri problemi sono quelli di ordine ecologico:
impatto sull'ambiente naturale (soprattutto per le centrali
idroelettriche), emissione di fumi e gas dannosi (da parte
delle centrali termoelettriche e dei motori a benzina e
gasolio), emissione di radiazioni nucleari e smaltimento
delle scorie radioattive (da parte delle centrali nucleari,
vedi la definizione D21).
![]() D30.
Prospettive molto interessanti sono offerte dalle fonti inesauribili
di energia, che in genere sono anche rispettose
dell'ecologia, ma di difficile sfruttamento: l'energia
eolica (quella prodotta dal vento), l'energia solare
(vedi l’esercizio E3), l'energia delle maree, l'energia
geotermica (quella prodotta dal calore dell'interno
terrestre).
D30.
Prospettive molto interessanti sono offerte dalle fonti inesauribili
di energia, che in genere sono anche rispettose
dell'ecologia, ma di difficile sfruttamento: l'energia
eolica (quella prodotta dal vento), l'energia solare
(vedi l’esercizio E3), l'energia delle maree, l'energia
geotermica (quella prodotta dal calore dell'interno
terrestre).
TABELLE
| Sostanza | Cal/kg | Sostanza | Cal/kg | Sostanza | Cal/kg |
| Combustibili | Cipolla, Carciofo | 460 | Pancetta | 6280 | |
| Alcool | 5800 | Cocomero | 280 | Pane bianco | 2630 |
| Benzina | 11.000 | Prosciutto cotto | 4250 | Pane integrale | 2400 |
| Carbone di legna | 6000 | Fagioli, Lenticchie | 3375 | Parmigiano | 3900 |
| Carbone coke | 7000 | Fagiolini | 350 | Pasta | 3770 |
| Gas di città | 7000 | Fico, Ananas | 790 | Patata | 760 |
| Gas liquido | 12.000 | Finocchio | 280 | Peperone, Spinaci | 250 |
| Gasolio | 10.200 | Fragola, Pesca | 380 | Orata | 800 |
| Idrogeno | 31.000 | Funghi | 280 | Pesce spada | 1200 |
| Legna | 3000-4500 | Gamberi | 910 | Piselli freschi | 980 |
| Metano | 12.800 | Gorgonzola | 3550 | Pollo | 2000 |
| Reazioni nucleari | Grissini, crostini | 3700 | Pomodoro (sugo) | 400 | |
| Fissione dell'Uranio | 2,0•1010 | Gruviera, Ricotta | 3800 | Pompelmo | 410 |
| Fusione dell'Idrogeno | 1,5•1013 | Latte intero | 3040 | Prosciutto crudo | 5020 |
| Alimenti | Lattuga, Cetriolo | 650 | Riso | 3620 | |
| Acciuga, Triglia | 1100 | Maiale magro | 140 | Salame | 4720 |
| Albicocca, Susina | 500 | Manzo magro | 1510 | Salmone | 1400 |
| Arancia, Mandarino | 450 | Marmellata | 1040 | Salsiccia | 3420 |
| Asparagi, Pomodoro | 210 | Mela, Ciliegia | 2780 | Sardine sott'olio | 2140 |
| Banana | 880 | Melone, Limone | 600 | Sogliola, Trota | 850 |
| Biscotti secchi | 4110 | Merluzzo | 200 | Tonno sott'olio | 2000 |
| Burro | 7180 | Miele | 740 | Uova | 1620 |
| Cacao | 2930 | Mozzarella | 2500 | Uva | 660 |
| Caprino, Scamorza | 3350 | Nocciole, Noci | 6500 | Vitello | 940 |
| Carota | 410 | Olio di oliva | 8910 | Yogurt | 620 |
| Cavolfiore | 250 | Olio di semi | 8840 | Zucchero | 3850 |
| Cioccolato fondente | 4710 | Olive | 1160 | Zucchina, Sedano | 170 |