| Piero Stroppa - Didattica e divulgazione scientifica | Home |
Didattica |
| Ripasso di Fisica per il Biennio delle Superiori |
| Unità 4. La struttura della materia |
| Definizioni e tabelle | ESERCIZI SVOLTI, ESPERIENZE E ATTIVITA' | Questionario |
| Attenzione:
se sei interessato a un argomento particolare, cercalo con il comando Trova (Ctrl+F) altrimenti, stampa questo documento e leggilo off-line |
![]() E1. Paragonando
le dimensioni del Sole al nucleo di un atomo, il sistema
solare risulterebbe più grande o più piccolo dell'intero
atomo?
E1. Paragonando
le dimensioni del Sole al nucleo di un atomo, il sistema
solare risulterebbe più grande o più piccolo dell'intero
atomo?
Svolgimento
Il raggio del Sole è uguale a 695.997 km (vedi Tabella
11 nell’Unità
2). Moltiplicando questo valore per 100.000 (vedi definizione
D14)
si ottiene, usando la notazione esponenziale:
r = 6,96•105 km • 105 = 6,96•1010 km
Questo sarebbe il raggio di un ipotetico atomo il cui nucleo fosse grande come il Sole. Il sistema solare è di un ordine di grandezza più piccolo; infatti, il raggio orbitale del pianeta più esterno del sistema solare (Plutone, vedi ancora la Tabella 11) è pari a 5,94•109 km.
![]() E2. Calcolare
la percentuale di massa atomica contenuta nel nucleo di un
atomo di carbonio.
E2. Calcolare
la percentuale di massa atomica contenuta nel nucleo di un
atomo di carbonio.
Svolgimento
Dalla Tabella 5 risulta che la massa media mC dell'atomo
di carbonio è uguale a 12,01 u. Per trasformare
questo valore in kilogrammi, bisogna moltiplicarlo per il
valore di u, dato nella Tabella
2 dell’Unità
1: u = 1,661•10-27 kg.
Si ha quindi:
mC = 12,01 • 1,661•10-27 = 1,995•10-26 kg
Il numero atomico del carbonio è 6, perciò l'atomo ha 6 elettroni (vedi definizione D17), la cui massa complessiva mel può essere calcolata sapendo la massa di un elettrone (vedi la Tabella 4 nell’Unità 2):
mel = 6 • 9,11•10-31 = 5,47•10-30 kg
Questa massa, rapportata alla massa totale dell’atomo equivale a:
mel / mC = 5,47•10-30 / 1,995•10-26 = 0,000274 = 0,0274%
Allora, poiché 100% - 0,0274% = 99,97%, si può concludere che la massa del nucleo rappresenta il 99,97% della massa atomica.
![]() E3. Calcolare
la massa della molecola di metano (CH4)
in unità u e in
kilogrammi. Quante moli contiene 1 kg di metano? Da quante
molecole è composto? Da quanti atomi?
E3. Calcolare
la massa della molecola di metano (CH4)
in unità u e in
kilogrammi. Quante moli contiene 1 kg di metano? Da quante
molecole è composto? Da quanti atomi?
Svolgimento
Cercando i simboli sulla Tabella 5, si ricava che la molecola di metano
è composta da un atomo di carbonio (C) e da 4 atomi di
idrogeno (H), per un totale di 5 atomi (vedi Nota 1). Quindi, utilizzando ancora il
valore di u (1,661•10-27 kg), la massa
molecolare media mmol risulta:
mmol = 1 • 12,01 + 4 • 1,01 = 16,05 u = 2,666•10-26 kg.
Una mole di metano è, per
definizione (D19),
pari a 16,05 g = 0,01605 kg.
Quindi, in 1 kg sono contenute: 1 / 0,01605 = 62,305 mol.
Il numero di molecole contenute in 1 kg di metano si ottiene moltiplicando questo valore per il Numero di Avogadro (vedi Tabella 4 dell’Unità 2):
n. mol. = 62,305 mol • 6,022•1023 = 3,752•1025.
Poiché nella molecola di metano ci sono 5 atomi, il numero totale di atomi è:
n. atomi = 5 • 3,752•1025 = 1,876•1026.
Una sigla come "CH4"
è una formula chimica. Essa serve per rappresentare
una molecola di un composto, infatti indica gli elementi di
cui è costituita, utilizzando i loro simboli (un elenco dei
più comuni è dato nella Tabella 5).
I numeri posti ai piedi dei simboli indicano quanti atomi di
ogni elemento entrano a far parte della molecola. Se non
viene indicato nessun numero, si sottintende che si ha un
solo atomo.
![]() E4. Calcola
l'ordine di grandezza della densità del nucleo dell'atomo di
carbonio.
E4. Calcola
l'ordine di grandezza della densità del nucleo dell'atomo di
carbonio.
Svolgimento
Consideriamo che il nucleo sia sferico, con le
dimensioni date nella definizione D14. Essendo 100.000 volte minore
dell’atomo, esso risulta avere un diametro d pari
a:
d = 10-10 m / 105 = 10-15
m
e un raggio r pari alla metà di questo valore. Quindi, il suo volume V risulta uguale a:
V = 4/3 p r3 = 4,19 • (0,5•10-15 m)3 = 0,5•10-45 m3
Poiché la massa del nucleo atomico è praticamente uguale a quella dell’intero atomo, come si è visto nell’esercizio E2, per calcolare la densità del nucleo basterà dividere la massa dell’atomo per il volume V. Come si è già calcolato nell’esercizio E2, la massa mC dell’atomo di carbonio è uguale a: mC = 12,01 • 1,661•10-27 = 1,995•10-26 kg
Quindi, si ha:
d = 1,995•10-26 kg / 0,5•10-45 m3 = 3,99•1019 kg/m3
Risulta una densità dell'ordine di 1019 kg/m3 (dieci miliardi di miliardi!).
![]() E5. Sono
più intense le interazioni nucleari deboli o le forze
elettriche? che rapporto di intensità c'è tra le due?
E5. Sono
più intense le interazioni nucleari deboli o le forze
elettriche? che rapporto di intensità c'è tra le due?
Svolgimento
Poiché le forze elettriche sono 10² volte meno intense
delle interazioni forti (vedi definizione D16), mentre le interazioni deboli sono
1016 volte meno intense delle interazioni forti
(vedi definizione D24), le forze elettriche risultano 1014
volte più intense delle interazioni deboli (infatti, 1016
/ 102 = 1014).
![]() E6. Determina
le masse dell'elettrone, del protone e del neutrone in unità
u. Qual è il
rapporto tra la massa del protone e quella dell'elettrone? (i
dati necessari li trovi nella Tabella
2 dell’Unità
1 e nella Tabella 4 dell’Unità 2).
E6. Determina
le masse dell'elettrone, del protone e del neutrone in unità
u. Qual è il
rapporto tra la massa del protone e quella dell'elettrone? (i
dati necessari li trovi nella Tabella
2 dell’Unità
1 e nella Tabella 4 dell’Unità 2).
Svolgimento.
Dividendo le massa in kilogrammi delle particelle
elementari (elettrone, protone e neutrone) per il valore
in kilogrammi dell’unità u, si ottengono i
seguenti risultati:
me = 0,000548 u, mp = 1,0072 u, mn = 1,0084 u
Il rapporto tra le masse del protone e dell’elettrone è uguale a:
mp /me = 1,0072 u / 0,000548 u = 1836,4
![]() E7. Calcola
i rapporti tra le masse e i numeri atomici riportati nella Tabella
5,
e riportali in un grafico, in funzione di Z. Che cosa si può
notare in questo grafico?
E7. Calcola
i rapporti tra le masse e i numeri atomici riportati nella Tabella
5,
e riportali in un grafico, in funzione di Z. Che cosa si può
notare in questo grafico?
Svolgimento
Il rapporto tra m e Z si mantiene intorno al
valore 2 negli atomi leggeri (per esempio,
nell’alluminio, m / Z = 26,99 / 13 = 2,076),
mentre cresce negli atomi pesanti (per esempio, nel tungsteno:
m / Z = 183,91
/ 74 = 2,485).
Questo significa che negli atomi pesanti il numero di
neutroni risulta sempre maggiore di Z; ciò i verifica
per una esigenza di stabilità dei nuclei di questi atomi,
dove le grosse dimensioni rendono più difficile il compito
delle forze nucleari di attrazione, che devono contrastare le
forze elettriche di repulsione tra i protoni.
![]() E8. Quante
molecole sono contenute in un litro di mercurio?
E8. Quante
molecole sono contenute in un litro di mercurio?
Svolgimento
Bisogna innanzitutto determinare la massa del mercurio,
usando il valore di densità riportato nella Tabella
6 dell’Unità
2. Poiché un litro equivale a 1 dm3, invertendo
la definizione di densità, si ha:
m = d • V = 13,6 kg/ dm3 • 1 dm3 = 13,6 kg = 13.600 g
Poiché una mole di mercurio equivale a 200,66 g (vedi Tabella 6) un litro è composto da 13.600 g / 200,66 g/mol = 67,78 mol. Moltiplicando questo valore per il Numero di Avogadro, si ottiene infine il numero di molecole:
n. mol = 67,78 • 6,022•1023 = 4,08•1025
![]() E9. Dieci
grammi di un elemento contengono 3,055•1022
atomi. Di quale elemento si tratta?
E9. Dieci
grammi di un elemento contengono 3,055•1022
atomi. Di quale elemento si tratta?
Svolgimento
Con una semplice proporzione possiamo calcolare la massa m
di una mole di questo elemento, sapendo che essa contiene un
numero di atomi pari al Numero di Avogadro:
10 g : 3,055•1022 = m : 6,022•1023
Quindi, si ha: m = 10 g • 6,022•1023 / 3,055•1022 = 197,1 g
Guardando la Tabella 5, si trova che l’elemento in questione è l’oro. Infatti, avendo l’oro una massa atomica di 197,1 u, una mole di questo elemento ha una massa di 197,1 g.
![]() E10. Calcola
la massa molecolare in unità u
e in grammi dell'acido solforico (H2SO4).
E10. Calcola
la massa molecolare in unità u
e in grammi dell'acido solforico (H2SO4).
Svolgimento
Dalla Tabella 5, si ricavano le masse atomiche degli atomi
contenuti nella molecola dell’acido solforico: H
(idrogeno): 1,01 u; S (zolfo): 32,08 u; O
(ossigeno): 16,00 u
Poiché la molecola contiene 2 atomi di idrogeno, uno di zolfo e 4 di ossigeno, la massa molecolare sarà:
m = 2 • 1,01 u + 32,08 u + 4 • 16,00 u = 98,1 u.
Moltiplicando questo valore per l’equivalente in kilogrammi di u, si ottiene la massa in kilogrammi della molecola, dalla quale, dividendo per 1000 (= 103), si ottiene la massa in grammi:
m = 98,1 u • 1,661•10-27 kg = 1,63•10-25 kg = 1,63•10-22 g
![]() E11. Determina
le masse in kilogrammi di una particella alfa, di una
particella beta e di una particella gamma.
E11. Determina
le masse in kilogrammi di una particella alfa, di una
particella beta e di una particella gamma.
Svolgimento
Poiché la particella alfa è composta da 2 protoni e
2 neutroni, prendendo le masse di queste particelle dalla Tabella
4 dell’Unità 2
si ha:
malfa = 2 • 1,673•10-27 kg + 2 • 1,675•10-27 kg = 6,696•10-27 kg
La particella beta è composta da un elettrone, quindi la sua massa è uguale alla massa di quest’ultimo: mbeta = 9,11•10-31 kg
La particella gamma è priva di massa (vedi definizione D23), quindi: mgamma = 0 kg
![]() E12. Quanti
protoni e quanti neutroni sono contenuti nel nucleo
dell'isotopo del radio di numero di massa 226? Quali saranno
i nuovi valori di Z
e di A dopo
l'emissione di una particella alfa da parte di questo nucleo?
E12. Quanti
protoni e quanti neutroni sono contenuti nel nucleo
dell'isotopo del radio di numero di massa 226? Quali saranno
i nuovi valori di Z
e di A dopo
l'emissione di una particella alfa da parte di questo nucleo?
Svolgimento
Poiché il radio possiede 88 protoni (vedi Tabella 5), il nucleo in questione possiede un
numero di neutroni pari alla differenza tra il numero di
massa e il numero atomico:
226 - 88 = 138 neutroni.
Se questo nucleo emette una particella alfa, contenente 2 protoni e 2 neutroni, il numero di massa diminuisce di 4 unità, mentre il numero atomico diminuisce di 2 unità. Quindi, si avrà:
A = 222; Z = 86
ESPERIENZE E ATTIVITÀ
![]() A1. Puoi
determinare approssimativamente le dimensioni di una
molecola di olio, eseguendo le seguenti operazioni:
A1. Puoi
determinare approssimativamente le dimensioni di una
molecola di olio, eseguendo le seguenti operazioni:
- Determina il volume di una goccia di olio, immettendo gocce in un piccolo recipiente graduato (per esempio, una siringa) con un contagocce, fino a raggiungere una delle gradazioni (per esempio, 1 ml), e dividendo questo valore per il numero di gocce immesse.
- Fai cadere una goccia d'olio sulla superficie dell'acqua contenuta in un recipiente: l'olio galleggerà, e si distenderà su una superficie che si può supporre costituita da uno strato spesso una sola molecola.
- Determina l'area di questa superficie, utilizzando il metodo descritto nell’esperienza A1 dell’Unità 2.
- A questo punto, dividendo il volume della goccia per l'area, ottieni un valore approssimativo del diametro molecolare.
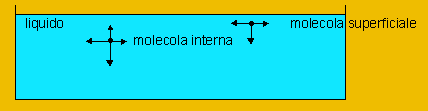
![]() A2. Le
molecole di un liquido sono sottoposte alle forze di coesione
in tutte le direzioni, ma quelle superficiali sono attirate
solo lateralmente e verso il basso. Ciò provoca una
compressione degli strati superficiali del liquido,
originando la cosiddetta tensione superficiale (vedi
la definizione D10).
A2. Le
molecole di un liquido sono sottoposte alle forze di coesione
in tutte le direzioni, ma quelle superficiali sono attirate
solo lateralmente e verso il basso. Ciò provoca una
compressione degli strati superficiali del liquido,
originando la cosiddetta tensione superficiale (vedi
la definizione D10).