| Piero Stroppa - Didattica e divulgazione scientifica | Home |
Didattica |
| Ripasso di Fisica per il Biennio delle Superiori |
| Unità 5. Temperatura e calore |
| DEFINIZIONI E TABELLE | Esercizi svolti, esperienze e attività | Questionario |
| Attenzione:
se sei interessato a un argomento particolare, cercalo con il comando Trova (Ctrl+F) altrimenti, stampa questo documento e leggilo off-line |
![]() D1. Le
molecole che costituiscono i corpi sono in continuo
movimento. Nei solidi questo movimento si limita a
oscillazioni delle molecole intorno alle loro posizioni
fisse, mentre nei fluidi è più libero (vedi le definizioni D7, D9, D12
dell’Unità 4).
In condizioni particolari, il moto molecolare può essere
osservato indirettamente al microscopio, ed è chiamato moto
browniano, dal nome del suo scopritore R. Brown.
D1. Le
molecole che costituiscono i corpi sono in continuo
movimento. Nei solidi questo movimento si limita a
oscillazioni delle molecole intorno alle loro posizioni
fisse, mentre nei fluidi è più libero (vedi le definizioni D7, D9, D12
dell’Unità 4).
In condizioni particolari, il moto molecolare può essere
osservato indirettamente al microscopio, ed è chiamato moto
browniano, dal nome del suo scopritore R. Brown.
![]() D2. Il moto
di agitazione molecolare aumenta all'aumentare della
temperatura del corpo, e perciò è detto anche agitazione
termica, poiché determina lo stato termico del
corpo. La temperatura è la grandezza che misura a
livello macroscopico lo stato termico di un corpo.
D2. Il moto
di agitazione molecolare aumenta all'aumentare della
temperatura del corpo, e perciò è detto anche agitazione
termica, poiché determina lo stato termico del
corpo. La temperatura è la grandezza che misura a
livello macroscopico lo stato termico di un corpo.
![]() D3. La
temperatura si misura con i termometri, e la sua
unità di misura usata più comunemente è il grado
centigrado (°C), che in prima approssimazione è
definito come la centesima parte della differenza tra la
temperatura dell'acqua in ebollizione e la temperatura del
ghiaccio mentre si fonde in acqua (in normali condizioni di
pressione atmosferica, vedi l’Unità
6).
D3. La
temperatura si misura con i termometri, e la sua
unità di misura usata più comunemente è il grado
centigrado (°C), che in prima approssimazione è
definito come la centesima parte della differenza tra la
temperatura dell'acqua in ebollizione e la temperatura del
ghiaccio mentre si fonde in acqua (in normali condizioni di
pressione atmosferica, vedi l’Unità
6).
![]() D4. La scala
Celsius delle temperature utilizza come unità il grado
centigrado, e pone uguale a zero la temperatura del ghiaccio
fondente: t = 0°C.
D4. La scala
Celsius delle temperature utilizza come unità il grado
centigrado, e pone uguale a zero la temperatura del ghiaccio
fondente: t = 0°C.
![]() D5. La
corrispondenza tra la temperatura e il moto molecolare
comporta l'esistenza di un limite inferiore per la
temperatura, che corrisponde all'assenza di moto molecolare.
Questo limite, detto zero assoluto, si trova alla
temperatura t = -273°C (vedi Nota
1 dell’Unità
6).
D5. La
corrispondenza tra la temperatura e il moto molecolare
comporta l'esistenza di un limite inferiore per la
temperatura, che corrisponde all'assenza di moto molecolare.
Questo limite, detto zero assoluto, si trova alla
temperatura t = -273°C (vedi Nota
1 dell’Unità
6).
![]() D6. I
termometri più comuni sfruttano per misurare la temperatura
il fenomeno della dilatazione termica, cioè l'aumento
delle dimensioni dei corpi in corrispondenza dell'aumento
della temperatura. Questo fenomeno è la manifestazione
macroscopica dell'aumento dello spazio occupato da ogni
singola molecola per effetto della sua maggiore agitazione,
che deriva dall'aumento della temperatura.
D6. I
termometri più comuni sfruttano per misurare la temperatura
il fenomeno della dilatazione termica, cioè l'aumento
delle dimensioni dei corpi in corrispondenza dell'aumento
della temperatura. Questo fenomeno è la manifestazione
macroscopica dell'aumento dello spazio occupato da ogni
singola molecola per effetto della sua maggiore agitazione,
che deriva dall'aumento della temperatura.
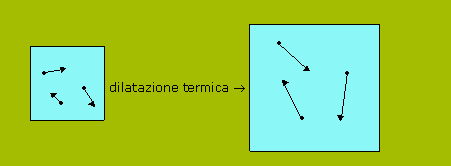
![]() D7. Nei termometri
a liquido (mercurio, o alcool) la temperatura viene letta
su una scala graduata applicata al tubicino di vetro in cui
è contenuto il liquido, il cui livello sale e scende a
seconda della temperatura. I termometri metallici sono
costituiti da una lamina metallica avvolta a spirale e
collegata a un indice. Quando la temperatura sale, la lamina
si allunga e l'indice segna la temperatura su un apposito
quadrante.
D7. Nei termometri
a liquido (mercurio, o alcool) la temperatura viene letta
su una scala graduata applicata al tubicino di vetro in cui
è contenuto il liquido, il cui livello sale e scende a
seconda della temperatura. I termometri metallici sono
costituiti da una lamina metallica avvolta a spirale e
collegata a un indice. Quando la temperatura sale, la lamina
si allunga e l'indice segna la temperatura su un apposito
quadrante.
![]() D8. La
variazione DL di lunghezza di un corpo,
ovvero la dilatazione lineare, è direttamente
proporzionale alla lunghezza iniziale Lo
e alla variazione di temperatura Dt
subita dal corpo. In formula:
D8. La
variazione DL di lunghezza di un corpo,
ovvero la dilatazione lineare, è direttamente
proporzionale alla lunghezza iniziale Lo
e alla variazione di temperatura Dt
subita dal corpo. In formula:
DL = l Lo Dt
![]() D9. La
costante di proporzionalità l
contenuta nella formula della dilatazione è il coefficiente
di dilatazione lineare, che dipende dalla sostanza di cui
è fatto il corpo (vedi Tabella 7). La sua unità di misura è 1/°C. Il
simbolo l corrisponde alla lettera l
dell'alfabeto greco e si legge "lambda".
D9. La
costante di proporzionalità l
contenuta nella formula della dilatazione è il coefficiente
di dilatazione lineare, che dipende dalla sostanza di cui
è fatto il corpo (vedi Tabella 7). La sua unità di misura è 1/°C. Il
simbolo l corrisponde alla lettera l
dell'alfabeto greco e si legge "lambda".
![]() D10. Una
proporzionalità analoga a quella data nella definizione D8 vale per la dilatazione volumica,
il cui coefficiente di dilatazione è pari a 3 l
.
D10. Una
proporzionalità analoga a quella data nella definizione D8 vale per la dilatazione volumica,
il cui coefficiente di dilatazione è pari a 3 l
.
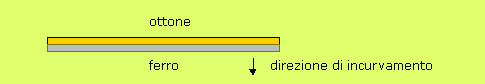
![]() D11. I termometri
bimetallici sono costituiti da due lamine di metalli
diversi (per esempio, ferro e ottone) saldate insieme. Quando
la temperatura sale, i due metalli si dilatano diversamente,
perciò la lamina bimetallica si incurva. Questi dispositivi
vengono spesso usati come termostati, cioè come
interruttori per la regolazione automatica dei dispositivi di
riscaldamento (forni, ferri da stiro, scaldabagni).
D11. I termometri
bimetallici sono costituiti da due lamine di metalli
diversi (per esempio, ferro e ottone) saldate insieme. Quando
la temperatura sale, i due metalli si dilatano diversamente,
perciò la lamina bimetallica si incurva. Questi dispositivi
vengono spesso usati come termostati, cioè come
interruttori per la regolazione automatica dei dispositivi di
riscaldamento (forni, ferri da stiro, scaldabagni).
![]() D12. Una
importante eccezione alla legge della dilatazione termica è
la dilatazione anomala dell'acqua, che tra 0°C e 4°C
diminuisce di volume invece di aumentare, a causa della sua
particolare struttura molecolare.
D12. Una
importante eccezione alla legge della dilatazione termica è
la dilatazione anomala dell'acqua, che tra 0°C e 4°C
diminuisce di volume invece di aumentare, a causa della sua
particolare struttura molecolare.
![]() D13. La
temperatura di un corpo può aumentare se viene fornito ad
esso del calore (Q), una forma di energia che
si ottiene facilmente dalle trasformazioni di altre forme di
energia; per esempio, combustioni, attriti, elettricità,
reazioni nucleari (vedi D18 e
seguenti dell’Unità15).
D13. La
temperatura di un corpo può aumentare se viene fornito ad
esso del calore (Q), una forma di energia che
si ottiene facilmente dalle trasformazioni di altre forme di
energia; per esempio, combustioni, attriti, elettricità,
reazioni nucleari (vedi D18 e
seguenti dell’Unità15).
![]() D14. Come
unità di misura del calore si usa spesso la Caloria
(simbolo Cal, o kcal), definita come la
quantità di calore necessaria per scaldare 1 kg di acqua
distillata da 14,5°C a 15,5°C. Nel SI viene usata come
unità di misura del calore la stessa unità di misura
dell'energia, cioè il joule (simbolo J), che
equivale a 2,39•10-4 Cal. Per la definizione
del joule, vedi la D2 dell’Unità 10.
D14. Come
unità di misura del calore si usa spesso la Caloria
(simbolo Cal, o kcal), definita come la
quantità di calore necessaria per scaldare 1 kg di acqua
distillata da 14,5°C a 15,5°C. Nel SI viene usata come
unità di misura del calore la stessa unità di misura
dell'energia, cioè il joule (simbolo J), che
equivale a 2,39•10-4 Cal. Per la definizione
del joule, vedi la D2 dell’Unità 10.
![]() D15. La
quantità di calore Q scambiata da un corpo per
variare la sua temperatura è direttamente proporzionale alla
massa m del corpo e alla variazione di temperatura Dt.
Questo si esprime con l'equazione del calore:
D15. La
quantità di calore Q scambiata da un corpo per
variare la sua temperatura è direttamente proporzionale alla
massa m del corpo e alla variazione di temperatura Dt.
Questo si esprime con l'equazione del calore:
Q = c • m • Dt
![]() D16. La
costante di proporzionalità c contenuta
nell'equazione del calore è il calore specifico della
sostanza di cui è costituito il corpo. E' la quantità di
calore necessaria per scaldare di 1°C un kilogrammo di
sostanza, e si misura in Cal/kg•°C (o in J/kg•°C).
Nella Tabella
8 sono riportati i
calori specifici di alcune sostanze. Per gli aeriformi i
valori sono dati in condizioni di pressione costante (P
cost, vedi le definizioni D4
e seguenti
dell’Unità 6). Il calore specifico di una sostanza
dipende anche dal suo stato di aggregazione, come si può
notare nella stessa Tabella a proposito dell'acqua.
D16. La
costante di proporzionalità c contenuta
nell'equazione del calore è il calore specifico della
sostanza di cui è costituito il corpo. E' la quantità di
calore necessaria per scaldare di 1°C un kilogrammo di
sostanza, e si misura in Cal/kg•°C (o in J/kg•°C).
Nella Tabella
8 sono riportati i
calori specifici di alcune sostanze. Per gli aeriformi i
valori sono dati in condizioni di pressione costante (P
cost, vedi le definizioni D4
e seguenti
dell’Unità 6). Il calore specifico di una sostanza
dipende anche dal suo stato di aggregazione, come si può
notare nella stessa Tabella a proposito dell'acqua.
![]() D17. Si
definisce capacità termica C di un corpo il
prodotto della sua massa m per il calore specifico c
della sostanza di cui è composto:
D17. Si
definisce capacità termica C di un corpo il
prodotto della sua massa m per il calore specifico c
della sostanza di cui è composto:
C = c • m
L'unità di misura della capacità termica è la Cal/°C (o il J/°C).
![]() D18. Due
corpi a temperatura diversa posti in comunicazione si
scambiano calore: il corpo a temperatura maggiore cede calore
a quello a temperatura inferiore, finché i due corpi
raggiungono la stessa temperatura, cioè la condizione di equilibrio
termico. La cessione del calore da parte del primo corpo
e l'acquisizione di calore da parte del secondo sono
governate dall'equazione del calore.
D18. Due
corpi a temperatura diversa posti in comunicazione si
scambiano calore: il corpo a temperatura maggiore cede calore
a quello a temperatura inferiore, finché i due corpi
raggiungono la stessa temperatura, cioè la condizione di equilibrio
termico. La cessione del calore da parte del primo corpo
e l'acquisizione di calore da parte del secondo sono
governate dall'equazione del calore.
![]() D19. La
verifica della equazione del calore si effettua in recipienti
isolati termicamente detti calorimetri, in cui gli
scambi di calore possono avvenire senza essere influenzati
dall'ambiente esterno (Gli stessi accorgimenti sono adottati
nel comune thermos).
D19. La
verifica della equazione del calore si effettua in recipienti
isolati termicamente detti calorimetri, in cui gli
scambi di calore possono avvenire senza essere influenzati
dall'ambiente esterno (Gli stessi accorgimenti sono adottati
nel comune thermos).
![]() D20.
L'isolamento termico si ottiene impedendo le tre modalità
con cui il calore può trasmettersi nei corpi e da un corpo
all'altro: per conduzione, per convezione e per
irraggiamento.
D20.
L'isolamento termico si ottiene impedendo le tre modalità
con cui il calore può trasmettersi nei corpi e da un corpo
all'altro: per conduzione, per convezione e per
irraggiamento.
![]() D21. Nei solidi
il calore si trasmette per conduzione, cioè tramite
gli urti tra le molecole, che si comunicano così il loro
moto di agitazione. E' una trasmissione lenta, che dipende
molto dal tipo di sostanza: sono buoni conduttori di
calore i metalli in genere, mentre sono cattivi conduttori, o
isolanti, sostanze come il legno, le plastiche, il
vetro.
D21. Nei solidi
il calore si trasmette per conduzione, cioè tramite
gli urti tra le molecole, che si comunicano così il loro
moto di agitazione. E' una trasmissione lenta, che dipende
molto dal tipo di sostanza: sono buoni conduttori di
calore i metalli in genere, mentre sono cattivi conduttori, o
isolanti, sostanze come il legno, le plastiche, il
vetro.
![]() D22. Nei fluidi
il calore si trasmette più velocemente, per convezione,
cioè per trasporto di materia: le parti calde, quindi
dilatate (vedi la definizione D6) e meno dense tendono a salire, per il
principio di Archimede (vedi la definizione D9
dell’Unità 6),
mentre quelle fredde tendono a scendere. Si crea così un
moto convettivo, che si esaurisce solo con il raggiungimento
dell'equilibrio termico.
D22. Nei fluidi
il calore si trasmette più velocemente, per convezione,
cioè per trasporto di materia: le parti calde, quindi
dilatate (vedi la definizione D6) e meno dense tendono a salire, per il
principio di Archimede (vedi la definizione D9
dell’Unità 6),
mentre quelle fredde tendono a scendere. Si crea così un
moto convettivo, che si esaurisce solo con il raggiungimento
dell'equilibrio termico.
![]() D23. Il calore può trasmettersi
anche nel vuoto, cioè in assenza di qualsiasi forma
di materia (per esempio, nello spazio esistente tra il Sole e
la Terra). Questo avviene grazie all'irraggiamento,
cioè all'emissione di radiazioni infrarosse da parte
dei corpi caldi, che provocano il riscaldamento dei corpi le
assorbono. Queste radiazioni sono onde elettromagnetiche che
si propagano alla velocità della luce (vedi Tabella 14 nell’Unità 14). Così, l'irraggiamento
è il meccanismo più veloce di trasmissione del calore. Si
può avere irraggiamento anche attraverso gli aeriformi
(per esempio, l'aria) e, parzialmente, anche nei fluidi
e nei solidi trasparenti (per esempio, il vetro).
D23. Il calore può trasmettersi
anche nel vuoto, cioè in assenza di qualsiasi forma
di materia (per esempio, nello spazio esistente tra il Sole e
la Terra). Questo avviene grazie all'irraggiamento,
cioè all'emissione di radiazioni infrarosse da parte
dei corpi caldi, che provocano il riscaldamento dei corpi le
assorbono. Queste radiazioni sono onde elettromagnetiche che
si propagano alla velocità della luce (vedi Tabella 14 nell’Unità 14). Così, l'irraggiamento
è il meccanismo più veloce di trasmissione del calore. Si
può avere irraggiamento anche attraverso gli aeriformi
(per esempio, l'aria) e, parzialmente, anche nei fluidi
e nei solidi trasparenti (per esempio, il vetro).
![]() D24. Un
importante effetto del calore è costituito dai cambiamenti
di stato che esso può causare nei corpi. Infatti,
l'energia che esso comunica alle molecole può provocare
l'indebolimento o la rottura dei legami molecolari che
distinguono i vari stati di aggregazione della materia (vedi
la definizione D1).
D24. Un
importante effetto del calore è costituito dai cambiamenti
di stato che esso può causare nei corpi. Infatti,
l'energia che esso comunica alle molecole può provocare
l'indebolimento o la rottura dei legami molecolari che
distinguono i vari stati di aggregazione della materia (vedi
la definizione D1).
![]() D25. Ogni
sostanza è caratterizzata da una temperatura di fusione
tf, al di sotto della quale essa è allo
stato solido, e da una temperatura di ebollizione
teb, al di sopra della quale è allo stato aeriforme.
Lo stato liquido è compreso tra le due temperature tf
e teb. I valori delle temperature di
fusione e di ebollizione di alcune sostanze sono dati nella Tabella 9.
D25. Ogni
sostanza è caratterizzata da una temperatura di fusione
tf, al di sotto della quale essa è allo
stato solido, e da una temperatura di ebollizione
teb, al di sopra della quale è allo stato aeriforme.
Lo stato liquido è compreso tra le due temperature tf
e teb. I valori delle temperature di
fusione e di ebollizione di alcune sostanze sono dati nella Tabella 9.
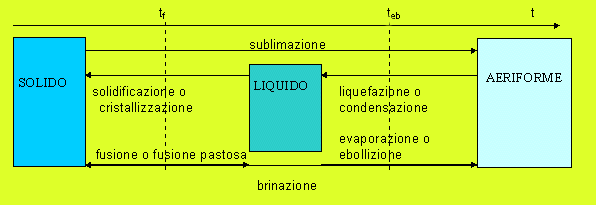
![]() D26. I nomi
dei vari cambiamenti di stato sono presentati nella figura
che segue. Sono da notare la sublimazione e la brinazione,
cioè i passaggi diretti tra solidi e aeriformi, che si
manifestano in condizioni particolari (per esempio, la
formazione della brina, o la sublimazione della canfora).
D26. I nomi
dei vari cambiamenti di stato sono presentati nella figura
che segue. Sono da notare la sublimazione e la brinazione,
cioè i passaggi diretti tra solidi e aeriformi, che si
manifestano in condizioni particolari (per esempio, la
formazione della brina, o la sublimazione della canfora).
![]() D27.
Fornendo calore a un solido cristallino (vedi la
definizione D7 dell’Unità 4) che si trova alla
temperatura di fusione, esso diventa liquido. Durante i
cambiamenti di stato non è valida l'equazione del calore
(vedi la definizione D15);
infatti, il calore fornito non provoca aumenti di temperatura
finché non è terminato il processo. La quantità di calore
necessaria per ottenere la fusione di un corpo di
massa m è data da:
D27.
Fornendo calore a un solido cristallino (vedi la
definizione D7 dell’Unità 4) che si trova alla
temperatura di fusione, esso diventa liquido. Durante i
cambiamenti di stato non è valida l'equazione del calore
(vedi la definizione D15);
infatti, il calore fornito non provoca aumenti di temperatura
finché non è terminato il processo. La quantità di calore
necessaria per ottenere la fusione di un corpo di
massa m è data da:
Q = Qf • m
dove Qf è
il calore latente di fusione, cioè il calore
necessario per fondere 1 kg della sostanza di cui è
costituito il corpo.
N.B.: l'aggettivo latente sta ad indicare che
durante il cambiamento di stato la temperatura non varia.
![]() D28. Il
passaggio inverso della fusione è la solidificazione,
o cristallizzazione: essa avviene alla stessa
temperatura tf, e comporta la restituzione
all'ambiente della stessa quantità di calore necessaria per
la fusione.
D28. Il
passaggio inverso della fusione è la solidificazione,
o cristallizzazione: essa avviene alla stessa
temperatura tf, e comporta la restituzione
all'ambiente della stessa quantità di calore necessaria per
la fusione.
![]() D29. I solidi
amorfi (vedi la definizione D7 dell’Unità 4) non hanno una
temperatura di fusione ben determinata, infatti il passaggio
da solido a liquido avviene in modo graduale, e viene detto fusione
pastosa. Il passaggio inverso (solidificazione)
avviene in modo analogo.
D29. I solidi
amorfi (vedi la definizione D7 dell’Unità 4) non hanno una
temperatura di fusione ben determinata, infatti il passaggio
da solido a liquido avviene in modo graduale, e viene detto fusione
pastosa. Il passaggio inverso (solidificazione)
avviene in modo analogo.
![]() D30. La vaporizzazione
di un liquido può avvenire in due modi: mediante ebollizione
o evaporazione. Per l'ebollizione vale quanto
detto per la fusione (nella definizione D27). In questo caso, il calore necessario per
operare il cambiamento è:
D30. La vaporizzazione
di un liquido può avvenire in due modi: mediante ebollizione
o evaporazione. Per l'ebollizione vale quanto
detto per la fusione (nella definizione D27). In questo caso, il calore necessario per
operare il cambiamento è:
Q = Qeb • m
dove Qeb è il calore latente di ebollizione.
![]() D31. I calori
latenti di fusione e di ebollizione si misurano in Cal/kg
(o in J/kg). Come le temperature di fusione ed
ebollizione, essi dipendono dalla struttura delle molecole e
dalle forze intermolecolari tipiche di ogni sostanza. Nella Tabella 9 sono riportati i calori latenti di
alcune sostanze.
D31. I calori
latenti di fusione e di ebollizione si misurano in Cal/kg
(o in J/kg). Come le temperature di fusione ed
ebollizione, essi dipendono dalla struttura delle molecole e
dalle forze intermolecolari tipiche di ogni sostanza. Nella Tabella 9 sono riportati i calori latenti di
alcune sostanze.
![]() D32. Un
liquido può vaporizzare anche a temperature inferiori a teb,
anche se in modo molto più lento: questo gli è consentito
dalla relativa libertà delle sue molecole, che possono
sfuggire dagli strati superficiali. Il fenomeno è detto evaporazione.
Anche il passaggio inverso può avvenire in due modi: è
detto condensazione quando avviene per raffreddamento
dell'aeriforme, e liquefazione quando avviene per
compressione (vedi la definizione D24
dell’Unità 6).
D32. Un
liquido può vaporizzare anche a temperature inferiori a teb,
anche se in modo molto più lento: questo gli è consentito
dalla relativa libertà delle sue molecole, che possono
sfuggire dagli strati superficiali. Il fenomeno è detto evaporazione.
Anche il passaggio inverso può avvenire in due modi: è
detto condensazione quando avviene per raffreddamento
dell'aeriforme, e liquefazione quando avviene per
compressione (vedi la definizione D24
dell’Unità 6).
TABELLE
TAB. 7.
COEFFICIENTI DI DILATAZIONE LINEARE
(valori medi tra 0° e 100°C)
| Sostanza | l (1/°C) | Sostanza | l (1/°C) |
| Acciaio Invar | 1,5•10-6 | Granito | 9,0•10-6 |
| Acqua | 1,7•10-4 | Legno (abete) | 3,0•10-6 |
| Alcool | 3,7•10-4 | Marmo | 7,0•10-6 |
| Alluminio | 2,2•10-5 | Mattoni | 6,0•10-6 |
| Argento | 1,8•10-5 | Mercurio | 6,0•10-5 |
| Benzolo | 4,1•10-4 | Oro | 1,4•10-5 |
| Bronzo | 1,8•10-5 | Rame | 1,6•10-5 |
| Cemento | 1,2•10-5 | Tungsteno | 4,5•10-6 |
| Ferro | 1,1•10-5 | Vetro | 8,0•10-6 |
TAB. 8.
CALORI SPECIFICI
(valori medi tra 0°C e 100°C, salvo diversa indicazione)
| Sostanza | Cal/kg•°C | Sostanza | Cal/kg•°C |
| Acciaio inox | 0,120 | Legno | 0,625 |
| Acqua | 1,000 | Mercurio | 0,033 |
| Acqua di mare | 0,939 | Metano | 0,593 |
| Alcool etilico | 0,580 | Olio | 0,472 |
| Alluminio | 0,217 | Oro | 0,031 |
| Argento | 0,056 | Pietra, cemento | 0,200 |
| Aria (P cost.) | 0,238 | Piombo | 0,031 |
| Benzina | 0,502 | Rame | 0,093 |
| Ferro | 0,114 | Tungsteno | 0,032 |
| Ghiaccio (a 0°C) |
0,530 | Vapore acqueo (a 100°C, P cost.) |
0,481 |
| Latte | 0,932 | Vetro | 0,118 |
TAB. 9. TEMPERATURE E CALORI DI FUSIONE ED EBOLLIZIONE
| Sostanza | Fusione |
Ebollizione |
||
| tf(°C) | Qf(Cal/kg) | teb(°C) | Qeb(Cal/kg) | |
| Acqua | 0 | 79,7 | 100 | 539 |
| Acqua marina | -3 | - | 103 | - |
| Alcool etilico | -114 | 24,9 | 78 | 204 |
| Azoto | -210 | 6,1 | -192 | 48 |
| Ferro | 1262 | 7,89 | 2750 | 1600 |
| Mercurio | -39 | 2,8 | 357 | 65 |
| Metano | -182 | 14,6 | -161 | 138 |
| Petrolio | -70 | - | 150 | - |
| Piombo | 327 | 5,9 | 1750 | 208 |
| Oro | 1063 | 14,4 | 2660 | 377 |
| Tungsteno | 3137 | 43,0 | 5654 | 640 |